• Robert J. Hawkins, B.Sc., DDS •
Contexte
Environ 3000 nouveaux cas de cancer de la bouche sont diagnostiqués au Canada chaque année. La plupart de ces cas surviennent chez des adultes âgés qui présentent des antécédents de tabagisme ou de consommation excessive d’alcool. Les interventions préventives pour ce cancer incluent le counseling des patients pour les amener à modifier les facteurs de risque et le dépistage pour découvrir les lésions précancéreuses ou à un stade initial. Le présent rapport présente des directives fondées sur les faits pour la prévention du cancer de la bouche et de ses précurseurs chez les patients asymptomatiques.
Méthodes
Les bases de données MEDLINE et CANCERLIT ont été dépouillées pour la période de 1966 à 1999. Le principal mot clé MeSH utilisé a été néoplasmes de la bouche (mouth neoplasms). Des références tirées d’articles et des recommandations d’organismes ont également été examinées. Les méthodes fondées sur les faits du Groupe de travail canadien sur les soins de santé préventifs ont été utilisées pour évaluer les données et établir des lignes directrices. Des avis d’experts ainsi que d’autres recommandations ont également été pris en considération.
Résultats
Des études de cohorte et cas/témoins ont révélé que le renoncement au tabac faisait diminuer le risque de cancer de la bouche et de ses précurseurs. Selon des essais contrôlés randomisés, le counseling par des professionnels spécialement formés est efficace pour favoriser le renoncement au tabac. Bien que le counseling soit efficace pour la réduction de la consommation excessive d’alcool, aucune étude n’a porté sur l’effet de la réduction de la consommation d’alcool sur le risque de cancer de la bouche ou de ses précurseurs. L’utilité du dépistage chez le grand public se trouve limitée par la prévalence et l’incidence peu élevées de la maladie, le risque de diagnostics faussement positifs, et le faible degré de conformité aux mesures de suivi recommandées. Rien n’indique que le dépistage chez le grand public ou au sein des groupes à risque conduit à une réduction de la mortalité ou de la morbidité attribuables au cancer de la bouche.
Interprétation
Les données sont suffisantes pour expressément considérer le counseling ayant pour but de faire renoncer au tabac dans un examen de santé périodique (recommandation de niveau A). En ce qui concerne le dépistage de masse, des données acceptables justifient d’exclure le dépistage du cancer de la bouche (recommandation de niveau D). Pour le dépistage opportuniste au cours d’examens périodiques, les données sont insuffisantes pour recommander l’inclusion ou l’exclusion du dépistage du cancer de la bouche (recommandation de niveau C). Dans le cas des patients à risque, un examen annuel par un médecin ou un dentiste devrait être envisagé. Les facteurs de risque incluent l’usage du tabac et la consommation excessive d’alcool. Ces recommandations sont semblables à celles du Groupe de travail canadien sur l’examen de santé périodique en 1994 et du Groupe de travail américain sur les services de prévention en 1996.
Mots clés MeSH : counselling; mouth neoplasms; oral cancer, prevention; screening.
© J Can Dent Assoc 1999; 65:617
Le cancer de la bouche compte pour environ 3 à 4 % de tous les cancers et 2 à 3 % des décès mettant en cause le cancer1. Plus de 90 % des cancers sont des épithéliomas spinocellulaires, localisés le plus souvent sur la langue et le plancher buccal (75 à 85 %). En dépit de la faible prévalence de la maladie dans les pays industrialisés, les taux de survie chez les patients qui présentent des lésions à un stade avancé est généralement de 50 % ou moins2. Une phase préclinique se manifeste par une lésion blanche ou rouge, mais un traitement hâtif peut porter les taux de survie à plus de 80 %3. Malheureusement, la plupart des patients (67 à 77 %) ne consultent pas avant que le cancer ne soit avancé et qu’une douleur persistante ne soit présente4.
Les interventions destinées à prévenir le cancer de la bouche sont entre autres le counseling des patients pour les amener à modifier les facteurs de risque (p. ex. usage du tabac et consommation excessive d’alcool) et le dépistage dans le but de déceler les lésions précancéreuses et à un stade initial. Des lignes directrices antérieures recommandaient que les professionnels de la santé conseillent aux patients de cesser de fumer5,6, mais des doutes existent au sujet de l’efficacité des mesures de dépistage. Un examen clinique visuel pour dépister le cancer de la bouche et ses précurseurs chez les sujets asymptomatiques a été préconisé comme moyen facile et non invasif de réduire la morbidité et la mortalité associées à la maladie2, laquelle semble par ailleurs répondre à nombre des critères justifiant des mesures de dépistage7. Toutefois, le dépistage du cancer de la bouche est sujet à controverse en Amérique du Nord en raison de la prévalence et de l’incidence peu élevées de la maladie; le nombre approximatif de nouveaux cas est de 3 000 au Canada et de 30 000 aux États-Unis8,9. Par conséquent, un grand nombre de gens doivent être soumis au dépistage pour que quelques-uns seulement en bénéficient, et les vies des personnes sauvées doivent être pondérées par rapport aux coûts financiers du dépistage et des diagnostics inexacts.
Fardeau de souffrance
L’incidence estimative du cancer de la bouche au Canada était de 3 090
cas en 1996, et le nombre estimatif de décès, de 1 070, 1,7 % de tous les décès par
cancer8. De 1987 à 1991, le nombre réel de nouveaux cas par année a peu
varié, oscillant entre 2 837 et 3 017. Le nombre de décès au cours de cette période
s’est établi entre 960 et 1 026. Les années potentielles de vie perdues à cause du
cancer de la bouche ont atteint 17 000 en 1993. La plupart des nouveaux cas ont été
diagnostiqués chez des hommes de 50 ans et plus (71 % de tous les cas); chez les hommes,
la probabilité d’apparition du cancer de la bouche passe de 0,2 à 1,7 % entre
l’âge de 50 ans et l’âge de 90 ans.
Les taux de survie déclarés à cinq ans sont souvent de 50 % ou moins. Ces taux ne se sont pas améliorés pour la peine depuis les années 1960, car le diagnostic est normalement porté après l’apparition de nodules et de métastases (stades III ou IV)9. Aux stades avancés de la maladie, la morbidité et la mortalité sont grandes, et le traitement peut entraîner une perte de fonction, de la douleur et le défigurement10,11. La parole, l’apparence et la capacité de mastiquer peuvent être altérées par la maladie ou le traitement. Une étude de suivi après un an a permis de constater la présence d’effets secondaires touchant la capacité de manger chez 23 patients sur 2512. Les coûts financiers de la maladie sont également élevés, puisque la rééducation et la mise en place de prothèses sont souvent nécessaires après le traitement.
Méthodes
Extraction des données
Entre janvier et mars 1999, les bases de données MEDLINE et CANCERLIT ont
été dépouillées pour la période de 1966 à 1999. Les mots clés MeSH et les termes
suivants ont été utilisés : néoplasmes de la bouche (mouth neoplasms), cancer de la
bouche (oral cancer), précurseurs du cancer (precancer), dépistage (screening),
surveillance de la population (population surveillance), thérapie (therapy),
désaccoutumance au tabac (smoking cessation), réduction de la consommation d'alcool
(alcohol reduction) et études d'évaluation (evaluation studies). Des articles ont
également été trouvés par suite de dépouillements manuels de journaux pertinents et
d’examens de références d’études appropriées. Seulement les articles dans
des journaux de langue anglaise ont été examinés.
Des critères d’inclusion et d’exclusion ont été utilisés pour choisir les études appropriées. Les rapports de cas, les opinions d’experts, les rapports de synthèse et les résumés ont été exclus. Les études de traitements du cancer et des précurseurs du cancer ont été incluses seulement lorsque les lésions se situaient au niveau de la cavité buccale ou de l’oropharynx : sièges 140 à 149 de la Classification internationale des maladies (CIM-9)13. Les articles au sujet du traitement du cancer devaient faire mention de patients chez qui la maladie était peu avancée. Les résultats particuliers du traitement aux stades I et II de la maladie devaient avoir été indiqués. (Le stade I renvoie à la classification TNM T1N0M0, et le stade II, à la classification TNM T2N0M0; à ces deux stades, ni nodules ni métastases ne sont présents.)
Évaluation critique et formation d’un consensus
Les données recueillies ont été systématiquement examinées selon la
méthodologie du Groupe de travail canadien sur les soins de santé préventifs. Ce groupe
de travail formé de cliniciens experts et de spécialistes de la méthodologie de
diverses spécialités médicales s’est servi d’une méthode normalisée,
fondée sur les faits, pour évaluer l’efficacité de l’intervention.
L’auteur principal a rédigé un manuscrit qui offrait une évaluation critique des
données. Les études clés ont été déterminées et soumises à une évaluation
critique, et leur qualité a été cotée selon l’échelle méthodologique établie
par le groupe de travail (Annexe 1). Le résultat a été un résumé de
conclusions et de recommandations proposées qui devaient être considérées par le
groupe de travail. Le manuscrit a préalablement été remis aux membres en avril 1998, et
les données pertinentes ont été présentées par l’auteur principal et ont fait
l’objet d’un débat à une réunion du groupe de travail en mai 1998.
À la réunion, les membres experts se sont penchés sur les questions critiques, ont clarifié les concepts ambigus, et ont analysé la synthèse des données. À la fin de ce processus, les recommandations cliniques précises de l’auteur principal ont été examinées, comme l’ont été les questions relatives à la clarification des recommandations en vue de leur application en clinique et tous besoins non comblés en fait de données. Les résultats de ce processus transparaissent dans la description des critères de décision présentés avec les recommandations particulières. Les décisions finales au sujet des recommandations ont été prises à l’unanimité par le groupe et l’auteur principal.
Des procédures pour assurer une documentation suffisante ainsi que l’uniformité, l’intégralité, l’objectivité et le respect de la méthodologie du groupe d’étude ont été suivies à toutes les étapes de l’examen, de la formation d’un consensus, et après. Ces procédures ont été appliquées par le bureau du groupe de travail, sous la supervision du président. Elles ont assuré l’uniformité et l’impartialité pendant tout le processus d’examen. La méthodologie détaillée est expliquée dans Woolf et collaborateurs14.
Résultats
Facteurs de risque
On a estimé qu’approximativement 75 % de toutes les tumeurs malignes
de la cavité buccale aux États-Unis sont attribuables au tabagisme et à la consommation
d’alcool, ou aux deux15. Des données d’études cas/témoins et
d’études de cohorte permettent de conclure à un lien de cause à effet entre ces
deux facteurs de risque et le cancer de la bouche15-21. Des études
cas/témoins aux États-Unis et au Canada ont mis en évidence une multiplication par
quatre ou plus des décès par cancer de la bouche chez les fumeurs et les personnes qui
abusent de l’alcool par rapport à l’ensemble de la population15,17,18.
Il existe une relation dose-effet entre ces deux facteurs et le cancer de la bouche, et
les deux ont un effet synergique lorsqu’ils sont combinés. Dans une étude, le
risque relatif (RR) chez les hommes qui fumaient beaucoup mais qui ne buvaient pas était
de 7,4; chez les non-fumeurs qui buvaient beaucoup, il était de 5,8; et chez les hommes
qui fumaient et buvaient beaucoup, il atteignait 37,715.
Bien qu’une interaction ait été démontrée, les effets indépendants du tabac et de l’alcool restent difficiles à déterminer, et les études font état de résultats contradictoires. Aussi bien le tabac22,23 que l’alcool18,24,25 a été présenté comme premier facteur de risque, alors que d’autres chercheurs sont arrivés à des résultats comparables pour les deux facteurs ou des différences selon les sexes15,16,26. De plus, deux études font état de différences selon le siège du cancer, l’alcool étant le principal facteur de risque pour le cancer de la bouche et du pharynx, et le tabac, le premier facteur pour le cancer du larynx18,20. Un obstacle de taille dans l’étude du tabac et de l’alcool comme facteurs de risque est que la plupart des personnes qui présentent un cancer de la bouche ont fait usage des deux produits. Des recherches plus poussées sont nécessaires pour déterminer la relation entre le cancer de la bouche, la consommation d’alcool et l’usage du tabac.
D’autres facteurs de risque du cancer de la bouche sont une tumeur maligne antérieure des voies aéro-digestives supérieures ou de la bouche27,28, avoir 60 ans ou plus29, la présence du papillomavirus30 et l’exposition à la lumière ultraviolette (cancer de la lèvre).31 Aucune corrélation n’a été démontrée entre le cancer de la bouche et le port de dentier ou la présence de biomatériaux dentaires32-34. Des études épidémiologiques ont mis en évidence une corrélation entre la mastication de bétel et le cancer de la bouche35,36. Il faut se demander, cependant, si le bétel seul augmente le risque de cancer de la bouche ou si l’effet est plutôt dû au tabac ajouté au mélange à mâcher36-38.
Manoeuvres
Counseling pour amener le patient à modifier les facteurs de risque. La
prévention primaire du cancer de la bouche peut passer par le counseling pour arrêter de
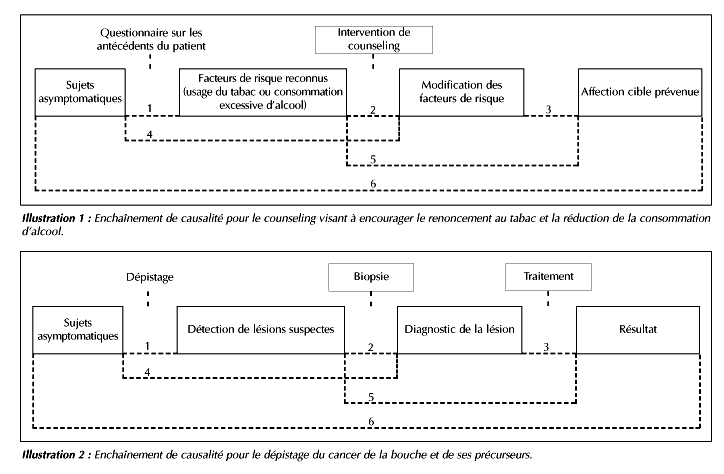
fumer ou réduire la consommation d’alcool. L’ill. 1 montre
l’enchaînement de causalité pour la manoeuvre de counseling.

Les données d’essais contrôlés randomisés attestent l’efficacité du counseling à l’endroit des adultes pour les encourager à cesser de fumer39,40. Il a été démontré que le counseling par les soignants fait augmenter les taux de renoncement au tabac sur une période de 6 à 12 mois par rapport aux interventions sans l’aide de soignants39-42. Les soignants dans les études en question étaient des médecins, des dentistes, des infirmières et des hygiénistes dentaires. Toutefois, nombre de professionnels de la santé, notamment les dentistes, manquent de formation ou d’intérêt pour encourager leurs patients à cesser de fumer. Les médecins plus que les dentistes disent conseiller de façon systématique à leurs patients de cesser de fumer; 30 à 40 % des dentistes en comparaison de 70 à 80 % des médecins déclarent conseiller à leurs patients de cesser de fumer43. Les résultats d’une étude auprès des patients de dentistes au sein de la population donnent également à penser que ces derniers sous-utilisent les conseils pour cesser de fumer44.
Dans des essais contrôlés randomisés, des conseils pour réduire la consommation excessive d’alcool, définie comme 15 consommations ou plus par semaine15, se sont révélés efficaces pour réduire sensiblement la consommation d’alcool chez les buveurs ainsi que la fréquence des épisodes de consommation excessive et la consommation excessive en général45-48. Une limite de ces études est qu’elles reposent sur des données auto-déclarées, bien que dans plusieurs études on ait aussi interviewé des membres de la famille pour corroborer les déclarations des sujets. Le counseling pour réduire la consommation d’alcool a été évalué chez les professionnels médicaux seulement. Les dentistes devraient adresser les patients qui ont des problèmes d’alcool à un professionnel médical compétent.
Dépistage du cancer et des précurseurs du cancer de la bouche. L’ill. 2 montre l’enchaînement de causalité pour la manoeuvre de dépistage. L’évaluation des mesures de dépistage porte sur a) la capacité des examinateurs de reconnaître les lésions suspectes et b) l’exactitude des diagnostics posés.
Tableau 1 Résultats d’études sur le dépistage du cancer de la bouche par examen clinique
| Étude | N | Examinateurs | Étalon-or | Sensibilité | Spécificité | Type de programme |
Mehta et coll.49 |
33,331 | 35 travailleurs de la santé formés | 2 dentistes | 56% | 98% | Programme de de la santé formés dépistage régional en Inde |
| Ikeda et coll.50 | 3,131 | 4 dentistes généralistes | 1 pathologiste de la bouche | 73% | 73% | Programme de dépistage de la bouche pour les travailleurs d’usine et de bureau au Japon |
| Downer et coll.51 | 553 | 2 dentistes généralistes | 1 spécialiste de la médecine buccale | 71% | 99% | Programme de dépistage médecine buccale d’entreprise à Londres (R.-U.) |
| Jullien et coll.52 | 985 | 2 dentistes généralistes | 1 spécialiste de la médecine buccale | 74% | 99% | Dépistage dans les médecine buccale cabinets de médecin et les hôpitaux dentaires au R.-U. |
| Mathew et coll.53 | 2,069 | 42 travailleurs de la santé formés | 3 médecins | 94% | 99% | Programme de dépistage de la santé formés régional en Inde |
Dans huit rapports d’interventions de dépistage de masse, la mise en évidence de lésions suspectes a été de moins de 6 % globalement, et dans cinq études, elle a été de moins de 2 % (Tableau 2)49-52,54-57. Pour les lésions cancéreuses, confirmées par biopsie, le rendement est beaucoup plus faible (pas plus de 0,05 %), et trois études n’ont même pas permis de découvrir une seule lésion cancéreuse. Des programmes de dépistage centrés sur les groupes à risque peuvent être d’un bien meilleur rendement pour les lésions aussi bien suspectes que confirmées. Un programme de dépistage chez les hommes alcooliques d’un certain âge dans le nord de l’Italie a révélé que 5 sujets sur 212 avaient un cancer de la bouche, pour un rendement de 2,4 %58.
Tableau 2
Lésions suspectes et cancéreuses décelées dans le cadre d’études de dépistage du cancer de la bouche par examen clinique
| Étude | N | Lieu | Rendement lésions suspectes (%) | Rendement lésions cancéreuse confirmées (%) | Nombre de lésions cancéreuses confirées |
| Bouquot and Gorlin54 | 23,616 | É.-U | 3.4 | 0.01 | 2 |
| Mehta and coll49 | 33,331 | Inde | 1.3 | 0.05 | 20 |
| Banoczy and coll55 | 7,820 | Hongrie | 1.3 | 0.05 | 1 |
| Ikeda and coll50 | 3,131 | Japon | 5.3 | 0.0 | 0 |
| Talamini and coll58 | 212 | Italie - groupe à risque | 9.5 | 2.4 | 5 |
| Downer and coll51 | 553 | R.-U. | 5.5 | 0.0 | 00 |
| Fernandez and coll56 | 13 millions | Cuba | 0.2 | 0.005 | 705 |
| Field and coll57 | 1,949 | R.-U. | 0.2 | 0.05 | 1 |
| Jullien and coll52 | 985 | R.-U. | 1.2 | 0.0 | 0 |
Les études ci-dessus doivent être interprétées avec prudence en raison de l’utilisation de spécialistes comme «autorités» aux fins de l’évaluation et du recours à différentes catégories de travailleurs de la santé comme examinateurs. D’autres écarts entre les études ont trait au protocole pour former les examinateurs, aux critères utilisés pour diagnostiquer les lésions, au cadre dans lequel les examens ont eu lieu, ainsi qu’au matériel et à la source de lumière utilisée. Comme il fallait s’y attendre, les plus fortes valeurs de diagnostic (94 % et 99 %) ont été obtenues dans l’étude où la formation était la plus poussée53. Dans cette étude, les examinateurs ont participé à un programme de six semaines de conférences et de formation clinique portant sur l’épidémiologie, le diagnostic, et la gestion et la prévention du cancer de la bouche et de ses précurseurs; les examinateurs ont ensuite subi une épreuve (écrite et pratique). Les meilleurs travailleurs de la santé d’après les résultats de cette épreuve ont été choisis comme examinateurs. Dans les autres études, les programmes de formation étaient moins poussés; ils duraient de deux à cinq jours49, ou leur durée n’était pas précisée50-52.
Les trois études où des dentistes faisaient fonction d’examinateurs ont donné des résultats semblables pour ce qui est de la sensibilité (71 à 74 %)50-52. Ces valeurs sont faibles comparativement à une sensibilité de 94 % dans une étude où l’on a eu recours à d’autres travailleurs de la santé53. Une explication possible serait que les dentistes dans ces études n’avaient pas été vraiment formés relativement à la normalisation, et n’avaient été qu’informés des critères de diagnostic pour déterminer les cas positifs et négatifs. Les résultats peu élevés pour ce qui est de la sensibilité peuvent refléter le manque général de formation des dentistes pour la détection du cancer de la bouche et de ses précurseurs, et leur manque de formation continue pour se tenir à jour. Aucune étude n’a encore porté sur la sensibilité et la spécificité des examens effectués par les médecins pour déceler le cancer de la bouche.
La coloration vitale des lésions suspectes au bleu de toluidine (chlorure de tolonium) pourrait servir d’adjuvant à l’examen visuel. La sensibilité et la spécificité sont élevées (97 % et 91 % en moyenne) lorsque la coloration est faite par des cliniciens d’expérience dans des établissements spécialisés, mais les caractéristiques de l’épreuve sont inconnues lorsque des cliniciens moins expérimentés s’en chargent dans des établissements généraux59,60. Aux fins du dépistage, les résultats d’une méta-analyse semblent indiquer que la coloration vitale est d’une utilité limitée compte tenu de la faible prévalence du cancer de la bouche59. Plus de lésions suspectes seraient mises en évidence, mais l’augmentation ne serait pas considérable.
Peu importe la manière dont les lésions suspectes réagissent à la coloration au bleu de toluidine, des tissus devraient être prélevés par biopsie dans tous les cas. La coloration ne saurait remplacer une biopsie ni un examen visuel et digital détaillé de la tête et du cou. Toutefois, les colorations de tissus peuvent aider les cliniciens à déterminer l’ampleur des lésions, à déterminer où pratiquer la biopsie, et à assurer le suivi des patients après le traitement du cancer61. Par conséquent, la coloration vitale comme moyen de dépistage de masse n’est pas encouragée, quoique cette technique puisse être utile pour évaluer les patients à risque et les lésions suspectes.
b) Le dépistage par examen clinique n’est pas censé avoir un but diagnostique. La biopsie est actuellement reconnue comme la méthode de choix pour diagnostiquer le cancer de la bouche. Toutefois, des études récentes de la concordance entre observateurs ont amené les chercheurs à mettre en doute la capacité des pathologistes de la bouche de diagnostiquer les cas sur la base d’un examen histologique. Trois études (une au Danemark et deux aux États-Unis) ont consisté à évaluer la concordance des diagnostics de dysplasies épithéliales (un des critères de diagnostic de malignité) entre pathologistes de la bouche62-64. Toutes les études comprenaient l’examen de spécimens histologiques par des pathologistes suivi d’une comparaison soit avec d’autres pathologistes, soit avec le diagnostic de sortie. Le nombre total de lames examinées par chaque observateur variait entre 100 et 120; les lames représentaient un spectre dysplasique qui allait, selon les auteurs, d’aucune dysplasie à une dysplasie sévère, ou cancer in situ. Les observateurs ont classé les dysplasies sur l’échelle suivante : nulle, légère, modérée et sévère. Les valeurs de Kappa pour la concordance exacte des diagnostics n’ont pas dépassé celles d’une concordance modérée, se situant entre 0,15 et 0,45.62,63 L’ajout de renseignements cliniques n’a pas amélioré la concordance; en fait, il l’a fait diminuer (0,10 à 0,23)64. La concordance à l’intérieur d’une seule classe de diagnostic était beaucoup plus nette, oscillant entre 0,70 et 0,8863. Des non-concordances de deux classes ou plus sont survenus dans 6 à 20 % des cas.
La plupart des différences de classification étaient d’une classe seulement; dans la plupart des cas, il est probable que les décisions relatives à la planification du traitement des cas n’auraient pas été réellement différentes. Toutefois, aucune étude n’a porté sur l’influence de l’évaluation de la biopsie sur la planification du traitement, et d’autres facteurs doivent aussi être pris en considération (p. ex. les antécédents du patient). Par conséquent, la signification clinique de différences entre examinateurs ne peut être que spéculative. Quoi qu’il en soit, ces résultats indiquent que la classification des dysplasies est une science inexacte. D’autres progrès de la biologie moléculaire peuvent rendre possibles une objectivité et une uniformité plus grandes dans l’évaluation des lésions et leur pronostic65.
Efficacité du counseling et du dépistage
Efficacité du counseling. Des études cas/témoins indiquent que le
renoncement au tabac réduit le risque d’apparition du cancer de la bouche15,23,66.
Les risques relatifs pour les ex-fumeurs deviennent égaux aux risques relatifs pour les
non-fumeurs après 10 ans sans tabac. De plus, une étude de suivi après dix ans en Inde
a révélé qu’un programme d’information sur les méfaits du tabagisme avait
fait diminuer l’incidence des lésions précancéreuses au sein de la cohorte visée
par l’intervention comparativement à l’incidence de ces lésions chez un groupe
témoin67. Toutefois, les programmes en milieu scolaire ont eu des résultats
mitigés 68-70, et les programmes de renoncement au tabac sans fumée ont été
évalués seulement dans des séries de cas limitées71.
Aucune étude n’a pu démontrer que la réduction de la consommation d’alcool se traduit par une réduction du risque du cancer de la bouche ou de ses précurseurs. Des recherches plus poussées sont nécessaires pour établir le lien entre la réduction de la consommation d’alcool et les résultats finals (c’est-à-dire les liens de causalité 3, 5 ou 6).
Efficacité du dépistage. À l’heure actuelle, une seule étude a apporté des données applicables au «lien de causalité 6», qui représente la relation probante la plus directe. Dans une étude non contrôlée d’un programme de dépistage du cancer de la bouche à Cuba, environ 13 millions d’examens ont été réalisés sur une période de six ans (1984-1990) dans des cabinets de dentiste commandités par l’État56. Bien que la proportion de cancers à un stade initial décelés par les examinateurs soit passée de 24 % à 49 %, l’incidence du cancer de la bouche et la mortalité qui lui est attribuable n’ont pas augmenté à Cuba au cours de la période de référence. Le programme n’a permis de déceler que 16 % des nouveaux cas de cancer de la bouche d’après le registre du cancer au cours de la période en question. Toutefois, l’utilité de ces résultats est limitée par des vices dans la conception de l’étude : l’absence de groupe témoin, et la période de référence qui peut avoir été trop courte pour qu’une amélioration quelconque puisse être décelée. Il est douteux que le programme de dépistage ait été mis en oeuvre de la façon prévue, car moins de 30 % des sujets qui présentaient des lésions suspectes ont suivi les recommandations qui leur ont été faites et moins du quart de la population cible a été soumis au dépistage chaque année.
Aucune étude contrôlée randomisée n’a encore permis d’évaluer l’efficacité du dépistage du cancer de la bouche. En 1995, une étude du genre a été entreprise en Inde, mais ses résultats ne seront pas connus d’ici 7 à 10 ans53. Lorsqu’ils le seront, ils devront être interprétés avec prudence parce qu’ils ne seront pas généralisables au Canada. La cavité buccale est le principal siège de cancer en Inde, et l’utilisation de programmes de dépistage de masse y est plus réalisable. Par contre, les résultats peuvent être applicables à certains sous-groupes à risque au Canada (p. ex. les personnes du Sud-Est asiatique).
Efficacité du traitement
Lésions précancéreuses de la bouche. Les précurseurs du cancer de la
bouche sont les lésions jugées potentiellement malignes parce qu’elles peuvent
révéler une dysplasie. La dysplasie épithéliale de la bouche peut se présenter
cliniquement comme une leucoplasie, une érythroplasie ou une leuco-érythroplasie. La
prévalence de ces lésions est très faible (1 à 4 %)54,55,72,73, et
celles-ci ne deviendraient malignes que dans 0,1 à 6 % des cas au sein de l’ensemble
de la population74-76, ou 7 à 36 % des cas chez les patients à risque77-80.
L’érythroplasie est considérée comme un signe précoce de cancer de la bouche
parce que les lésions érythroplasiques ou leuco-érythroplasiques risquent davantage de
devenir malignes que les légions leucoplasiques79, et que la plupart des
cancers invasifs sont rouges ou surtout rouges (64 à 86 %)81,82. Une autre
sorte de lésion maligne, le lichen plan, est aussi peu répandue (0,1 à 2 %)54,55,83
et devient rarement maligne (0,4 à 3 %)84-87. À l’heure actuelle, il est
impossible de dire quelles lésions précancéreuses deviendront éventuellement malignes.
Pour les lésions localisées, l’exérèse chirurgicale est le traitement normal, mais son efficacité n’a pas vraiment été évaluée dans des études contrôlées randomisées. Des études par observation ont révélé qu’après le traitement, le taux de récurrence des lésions précancéreuses est d’environ 20 %, et que le risque d’apparition de lésions malignes n’est pas éliminé (5 %)88-90. Le nombre de lésions dont l’exérèse chirurgicale empêche de devenir malignes ne peut être déterminé d’après ces études. Une autre forme de traitement, l’exérèse au laser, reste à évaluer dans des essais cliniques bien conçus91.
L’endroit et l’étendue de certaines lésions peuvent en rendre l’exérèse chirurgicale difficile. Trois traitements ont été évalués pour ces lésions dans le cadre d’essais cliniques : l’acide rétinoïque 13-cis (13cRA)92,93, le bêta-carotène (un précurseur du rétinol)94 et la bléomycine95. Dans un essai contrôlé randomisé, de fortes doses de 13cRA se sont révélées plus efficaces qu’un placebo pour inverser et stabiliser la leucoplasie buccale; toutefois, les effets secondaires et la rechute après l’abandon du traitement ont représenté d’importants problèmes92. Une étude comparative récente d’un schéma posologique de faibles doses de 13cRA a montré que cet acide était plus efficace que le bêta-carotène, la lésion devenant maligne chez seulement 8 % des sujets soumis à ce traitement, en comparaison de 55 % de ceux qui ont été traités au bêta-carotène93. Les effets secondaires étaient plus courants chez les sujets traités au 13cRA, mais seulement de légères complications ont été signalées. Un troisième agent, la bléomycine topique, s’est révélé plus efficace qu’un placebo pour faire diminuer la taille des lésions dans un essai contrôlé randomisé auquel participaient des patients présentant une leucoplasie buccale95. Aucune étude n’a comparé le traitement au 13cRA et le traitement à la bléomycine.
Lésions malignes à un stade initial. Les lésions malignes mises en évidence par des examens de dépistage sont normalement à un stade initial (I ou II); la langue et le plancher buccal sont les sièges les plus courants de ces lésions. Aucune étude contrôlée n’a encore permis d’évaluer la chirurgie ou la radiothérapie. Depuis 1980, neuf études ont présenté des données d’examens rétrospectifs de dossiers de patients (Tableau 3)96-104. La seule mesure fournie dans toutes les études est le taux de survie à cinq ans; pour le stade I, ce taux varie entre 57 % et 90 %, et pour le stade II, entre 41 % et 72 %. Un problème que pose l’analyse statistique de ces données est que l’influence d’un biais introduit par l’intervalle de latence n’a pas été prise en considération.
Tableau 3 Résultats d’études* sur le traitement du cancer de la bouche à un stade initial (stades I et II)
| Étude | N | Intervention | Siège | Résultat (Taux de survie à 5 ans) |
Decroix et Ghossein96 |
382 | Radiothérapie ou combinaison | Langue | Stade I - 57% Stade II - 41% |
Callery et coll97 |
546 | Chirurgie | Langue | Stade I - 65%
Stade II - 58% |
Mendenhall et coll98 |
132 | Radiothérapie | Langue | Stade II - 54% |
Nason et coll99 |
209 |
Chirurgie |
Plancher buccal | Stade I - 69% Stade II - 64% |
Wildt et coll100 |
267 | Chirurgie (40%) Radiothérapie (40 %) Combiné (22 %) | Divers sièges : surtout mandibulaire | Stade I - 65% Stade II - 42% |
| Soderholm101 | 162 | Chirurgie (20 %) Radiothérapie (18 %) Combiné (62 %) | Région mandibulaire | Stade I - 80% Stade II - 58% |
Franceschi et coll102 |
297 |
Chirurgie | Langue | Stade I - 90% Stade II - 72% |
| Kraus et coll.103 | 100 | Chirurgie | Langue | Stade I/II - 77 % |
| Lefebvre et coll.104 | 429 | Radiothérapie | Divers sièges : surtout langue et plancher buccal | Stade I - 61 %Stade II - 50 % |
*Toutes les études étaient des séries de cas.
Une comparaison valide de la chirurgie et de la radiothérapie est difficile en raison de la piètre qualité des études et de l’incapacité de tenir compte des différences entre les patients d’une étude à l’autre. Puisque des conclusions certaines peuvent seulement être tirées d’essais contrôlés randomisés, les taux de survie ne peuvent pour l’instant être considérés autrement que comme comparables pour la chirurgie et la radiothérapie. Un autre problème que pose l’évaluation du traitement du cancer, c’est que les taux de récurrence pour des stades de cancer particuliers ne sont pas spécifiés dans la plupart des études. Seulement deux études ont consigné les taux de survie à cinq ans pour le stade I (12 à 14 %) et le stade II (18 à 22 %)96,104.
Enfin, peu d’études nous renseignent sur l’effet relatif du traitement sur la qualité de vie et la fonction buccale. Le temps de survie seulement n’est pas une mesure satisfaisante du succès du traitement; la qualité de la survie doit être évaluée tout autant que sa durée. Jusqu’ici, des mesures subjectives des résultats ont été utilisées surtout dans des études du traitement des cancers à un stade avancé10-12. Aucune étude n’a comparé l’état de santé des personnes qui ont été traitées à l’état de santé d’autres personnes qui ont refusé d’être traitées.
Interprétation
Recommandations du Groupe de travail canadien
Le Tableau 4 résume les recommandations préparées par suite de
cet examen. Des données justifient la recommandation que le counseling pour encourager
les patients à cesser de fumer soit expressément considéré au moment d’un examen
de santé périodique (recommandation de niveau A). Aucune recommandation particulière
n’est faite relativement au counseling pour la réduction de la consommation
d’alcool comme moyen de prévenir le cancer de la bouche; toutefois, le counseling
des buveurs peut être recommandé pour d’autres raisons. Le groupe d’étude a
fait de ce counseling une recommandation de niveau B en 1994105.
Tableau 4 Tableau sommaire des recommandations pour la prévention de la mortalité par cancer de la bouche
| Manoeuvre | Efficacité | Qualité des données | Recommandation |
| Counseling pour encourager le renoncement au tabac | Les interventions multiples et les
initiatives de renforcement ont augmenté les taux de désaccoutumance de 6 mois et 1 an. Il a été démontré que le renoncement au tabac réduisait le risque de cancer de la bouche. Les programmes d’intervention ont réduit l’incidence des lésions précancéreuses.
|
Essais contrôlés randomisés39,40
(I)
Études cas/témoins et études de cohorte15,23,66,67 (II-2) |
Données suffisantes pour consi dérer
expressément le counseling visant à encourager le renoncement au tabac dans un examen de
santé périodique (A) Le counseling devrait être assuré par des professionnels de la santé formés. |
| Dépistage par examen clinique | L’utilité du dépistage est limitée
par la prévalence et l’incidence peu élevées de la maladie, le risque de faux
positifs, et le manque de conformité aux mesures de suivi recommandées. Aucune étude n’a démontré que les programmes de dépistage réduisent la mortalité et la morbidité attribuables au cancer de la bouche. |
Études cas/témoins49-58 (II-2) | Dépistage de masse : Données
acceptables pour exclure le dépistage de masse du cancer de la bouche par examen clinique
(D) Dépistage opportuniste : Données insuffisantes pour recommander l’inclusion ou l’exclusion du dépistage du cancer de la bouche par examen clinique chez des patients asymptomatiques dans un examen de santé périodique (C) Pour les patients à risque, un examen annuel par un médecin ou un dentiste devrait être considéré. Les principaux facteurs de risque sont des antécédents de tabagisme et une consommation excessive d’alcool.excessive d’alcool. |
Les recommandations de dépistage sont divisées en deux catégories : le dépistage de masse, et le dépistage opportuniste (c’est-à-dire à l’occasion des examens de santé périodiques). En ce qui concerne le dépistage de masse, une recommandation de niveau D a été faite en raison de la prévalence et de l’incidence peu élevées du cancer de la bouche au Canada, des faibles rendements constatés dans les études de dépistage, et du risque de proportions élevées de diagnostics faussement positifs. Les faux positifs peuvent constituer un problème de taille en raison des coûts personnels et financiers, de l’anxiété, des biopsies inutiles et des traitements non indiqués qui peuvent en résulter.
En ce qui concerne le dépistage opportuniste des patients asymptomatiques, une recommandation C a été formulée, semblable à la recommandation du Groupe de travail en 19945. Dans le cas des patients à risque, un examen annuel par un médecin ou un dentiste devrait être considéré. L’usage du tabac et la consommation excessive d’alcool, seuls ou en combinaison, sont les principaux facteurs de risque liés à l’apparition du cancer de la bouche.
Recommandations d’autres instances
Les recommandations en faveur du counseling pour encourager les patients à
cesser de fumer sont conformes aux lignes directrices établies par le ministère
américain de la Santé et des Services humains (1996)6. Les recommandations en
ce qui a trait au dépistage dans le présent rapport sont conformes aux recommandations
du Groupe de travail américain sur les services de prévention et du Groupe de travail
britannique sur le cancer de la bouche106-108. Les deux groupes ont recommandé
le dépistage seulement pour les groupes à risque. Par contre, la Société américaine
du cancer préconise le dépistage systématique chez les sujets asymptomatiques de plus
de 20 ans109. Les organismes représentant les dentistes appuient également le
concept du dépistage du cancer de la bouche, bien qu’il n’existe aucune
déclaration officielle en ce sens110,111.
La qualité des données demeure une importante préoccupation dans l’évaluation du dépistage du cancer de la bouche. Aucun essai prospectif contrôlé n’a encore mis en corrélation le dépistage et les cancers de la bouche évités. Comme pour le dépistage d’autres formes de cancer, «le problème… n’est pas la preuve d’un manque d’effet, mais le manque de preuves»112.
Programme de recherche
1. Au Canada, un programme national de dépistage a peu de chances
d’être un moyen de dépistage pratique. Toutefois, l’évaluation prospective
des programmes de dépistage pour les groupes à risque est justifiée, car les facteurs
de risque sont connus et reconnaissables. Les sujets à risque peuvent être identifiés
par un processus de dépistage en deux étapes : un questionnaire à remplir soi-même
pour trouver les patients chez qui des facteurs de risque sont présents, et un examen
ultérieur visant à déceler le cancer de la bouche chez les sujets considérés comme à
risque. Le dépistage pratiqué chez les groupes à risque seulement augmenterait sans
doute le rendement des programmes de dépistage et pourrait devenir plus rentable113,114.
Toutefois, une étude de dépistage auprès des hommes alcooliques d’un certain âge
donne à penser qu’il serait coûteux de repérer les personnes à risque, et que la
conformité aux mesures de suivi recommandées serait faible (34 %)58. Par
conséquent, des façons rentables de repérer ces sujets et des programmes de suivi
efficaces sont nécessaires.
2. Un autre point à éclaircir est le suivant : quels professionnels de la santé devraient procéder à l’examen de dépistage et aux interventions de counseling? Dans une étude de cas pour lesquels un examen plus poussé avait été recommandé, les médecins ont décelé une plus forte proportion de cancers localisés au niveau du pharynx, du larynx et des amygdales, alors que les dentistes en ont trouvé un plus grand pourcentage sur les gencives et le plancher buccal115. Les dentistes reconnaissaient aussi plus facilement les cas asymptomatiques, à un stade initial, de cancer et les précurseurs du cancer, alors que les patients symptomatiques se présentent habituellement chez un médecin pour être examinés.
Les dentistes et les médecins généralistes sont en mesure de déceler les lésions cancéreuses et précancéreuses dans leur pratique, mais on ne sait pas si l’une des professions est plus apte à le faire que l’autre. Bien que les dentistes examinent la bouche plus fréquemment et devraient théoriquement mieux connaître les différences entre l’état pathologique et les écarts par rapport à cet état, des études où des dentistes généralistes ont fait fonction d’examinateurs aux fins du dépistage ont révélé une sensibilité variant entre 71 et 74 %50-52, ce qui dénote un fort taux de faux négatifs. On a également constaté que les travailleurs médicaux de première ligne avaient de la difficulté à reconnaître les lésions buccales116. Le manque de formation et de sensibilisation chez les praticiens en médecine et en dentisterie a été relevé117-119.
On a laissé entendre que divers professionnels de la santé devraient jouer un rôle dans le counseling et le dépistage, et que l’accent devrait être mis sur le niveau de formation et l’intérêt plutôt que sur l’appartenance à une profession en particulier6. Du point de vue de la rentabilité, il coûterait beaucoup moins cher de faire appel aux infirmières, aux infirmières auxiliaires et aux hygiénistes dentaires.
3. Des études plus poussées sont nécessaires pour établir un lien de causalité entre la réduction de la consommation d’alcool et un risque réduit de cancer de la bouche et de précurseurs de ce cancer. Une étude cas/témoins serait le moyen le plus réaliste d’examiner ce facteur de risque, mais un nombre suffisant de sujets serait nécessaire pour tenir compte des effets du tabagisme.
Membres du Groupe de travail canadien sur les soins de santé
préventifs
Président : Dr John W. Feightner, professeur, Département de
médecine familiale, Université Western Ontario, London (Ont.). Président sortant :
Dr Richard Goldbloom, professeur, Département de pédiatrie, Université
Dalhousie, Halifax. Membres : Drs R. Wayne Elford, professeur émérite,
Département de médecine familiale, Université de Calgary, Calgary; Michel Labrecque,
professeur agrégé et directeur de recherche, Département de médecine familiale et
Centre hospitalier universitaire de Québec, Université Laval, Québec; Harriet
MacMillan, professeure agrégée, Départements de psychiatrie et de pédiatrie et Centre
for Studies of Children at Risk, Université McMaster, Hamilton (Ont.); Robin McLeod,
professeur, Département de chirurgie, Mount Sinai Hospital et Université de Toronto,
Toronto; Jean-Marie Moutquin, professeur, Département d’obstétrique et de
gynécologie et Centre de recherche de l’Hôpital Saint-François d’Assise du
CHUQ, Université Laval, Québec; Christopher Patterson, professeur et chef, Division de
médecine gériatrique, Département de médecine, Université McMaster, Hamilton (Ont.);
Elaine E.L. Wang, professeure agrégée, Départements de pédiatrie et des sciences de la
santé publique, Faculté de médecine, Université de Toronto, Toronto. Personnes-ressources
: Nadine Wathen, coordonnatrice, Groupe de travail canadien sur les soins de santé
préventifs, Département de médecine familiale, Université Western Ontario, London
(Ont.), et Tim Pauley, adjoint de recherche, Groupe de travail canadien sur les soins de
santé préventifs, Département de médecine familiale, Université Western Ontario,
London (Ont.).
Remerciements : Nous tenons à remercier le Dr Joel B. Epstein, de l’Agence du cancer de la Colombie-Britannique, à Vancouver, et le Dr Thomas D. Daley, Département de pathologie buccale, Université Western Ontario, London (Ont.), qui ont revu l’ébauche du présent rapport. Les points de vue exprimés dans le présent rapport sont ceux de l’auteur et du groupe de travail, et ne reflètent pas nécessairement les positions des personnes qui l’ont revu.
Le Dr Hawkins est un étudiant diplômé en dentisterie communautaire, Faculté de dentisterie, Université de Toronto.
Le Dr Wang est professeur agrégé aux Départements de pédiatrie et de sciences de la santé publique, Faculté de médecine, Université de Toronto.
Le Dr Leake est professeur de dentisterie communautaire, Faculté de dentisterie, Université de Toronto.
Les points de vue exprimés sont ceux des auteurs et ne correspondent pas nécessairement à l’opinion ou aux politiques officielles de l’Association dentaire canadienne.
Annexe 1
Groupe de travail canadien sur les soins de santé préventifs : qualité des résultats et classification des recommandations
| Qualité des résultats publiés | |
| I | Résultats obtenus dans le cadre d’au moins un essai comparatif convenablement randomisé. |
| II-1 | Résultats obtenus dans le cadre d’essais comparatifs non randomisés bien conçus. |
| II-2 | Résultats obtenus dans le cadre d’études de cohorte ou d’études analytiques cas/témoins bien conçues, réalisées de préférence dans plus d’un centre ou par plus d’un groupe de recherche. |
| II-3 | Résultats découlant de comparaisons entre différents moments ou différents lieux, ou selon qu’on a ou non recours à une intervention. |
| III | Opinions exprimées par des sommités dans le domaine, fondées sur l’expérience clinique, études descriptives ou rapports de comités d’experts. |
| Classification des recommandations | |
| A | Données suffisantes pour appuyer la recommandation selon laquelle il faudrait s’intéresser expressément à cette affection dans le cadre d’un examen médical périodique. |
| B | Données acceptables pour appuyer la recommandation selon laquelle il faudrait s’intéresser expressément à cette affection dans le cadre d’un examen médical périodique. |
| C | Données insuffisantes pour appuyer l’inclusion ou l’exclusion de cette affection dans le cadre d’un examen médical pério dique, mais les recommandations peuvent reposer sur d’autres fondements. |
| D | Données acceptables pour appuyer la recommandation de ne pas s’intéresser à cette affection dans le cadre d’un examen médical périodique. |
| E | Données suffisantes pour appuyer la recommandation de ne pas s’intéresser à cette affection dans le cadre d’un examen médical périodique. |
Références
1. Parkin DM, Laara E, Muir CS. Estimates of the worldwide frequency of sixteen major cancers in 1980. Int J Cancer 1988; 41:184- 97.
2. Silverman S Jr. Early diagnosis of oral cancer. Cancer 1988; 62:1796-9.
3. Speight PM, Morgan PR. The natural history and pathology of oral cancer and precancer. Community Dent Health 1993; 10(Suppl 1):31-41.
4. Guggenheimer J, Verbin RS, Johnson JT, Harkowitz CA, Myers EN. Factors delaying the diagnosis of oral and oropharyngeal carcinomas. Cancer 1989; 64:932-5.
5. Rosati C. Prevention of Oral Cancer. In: The Canadian guide to clinical practice health care. The Canadian Task Force on the Periodic Health Examination. Ottawa: Minister of Supply and Services, 1994.
6. Fiore MC, Bailey WC, Cohen SJ, and others. Smoking Cessation. Clinical Practice Guideline No. 18. Rockville, MD: U.S. Department of Health and Human Services, Public Health Service, Agency for Health Care Policy and Research. AHCPR Publication No. 96-0692. April 1996.
7. Hill GB, Spitzer WO, Ferenzi LZ. Optimal frequency of examinations aimed at detecting pre-symptomatic disease. Can J Public Health 1984; 75:419-24.
8. National Cancer Institute of Canada. Canadian Cancer Statistics 1996. Toronto, Canada, 1996.
9. Wingo PA, Tong T, Bolden S. Cancer statistics, 1995 [published erratum appears in CA Cancer J Clin 1995; 45:127-8]. CA Cancer J Clin 1995; 45:8-30.
10. Bundgaard T, Tandrup O, Elbrond O. A functional evaluation of patients treated for oral cancer. A prospective study. Int J Oral Maxillofac Surg 1993; 22:28-34.
11. Rathmell AJ, Ash DV, Howes M, Nicholls J. Assessing quality of life in patients treated for advanced head and neck cancer. Clin Oncol (R Coll Radiol) 1991; 3:10-6.
12. Beeken L, Calman F. A return to “normal eating” after curative treatment for oral cancer. What are the long-term prospects? Eur J Cancer B Oral Oncol 1994; 30B:387-92.
13. World Health Organization. Application of the international classification of diseases to dentistry and stomatology. Geneva: WHO, 1978.
14. Woolf SH, Battista RN, Anderson GM, Logan AG, Wang E. Assessing the clinical effectiveness of preventive maneuvers: analytic principles and systematic methods in reviewing evidence and developing clinical practice recommendations. A report by the Canadian Task Force on the Periodic Health Examination. J Clin Epidemiol 1990; 43:891-905.
15. Blot WJ, McLaughlin JK, Winn DM, Austin DE, Greenberg RS, Preston-Martin S, and others. Smoking and drinking in relation to oral and pharyngeal cancer. Cancer Res 1988; 48:3282-7.
16. Rothman K, Keller A. The effect of joint exposure to alcohol and tobacco on the risk of cancer of the mouth and pharynx. J Chronic Dis 1972; 25:711-6.
17. Schmidt W, Popham RE. The role of drinking and smoking in mortality from cancer and other causes in male alcoholics. Cancer 1981; 47:1031-41.
18. Elwood JM, Pearson JC, Skippen DH, Jackson SM. Alcohol, smoking, social and occupational factors in the aetiology of cancer of the oral cavity, pharynx and larynx. Int J Cancer 1984; 34:603-12.
19. Zheng TZ, Boyle P, Hu HF, Duan J, Jiang PJ, Ma DQ, and others. Tobacco smoking, alcohol consumption and risk of oral cancer: a case-control study in Beijing, People’s Republic of China. Cancer Causes Control 1990; 1:173-9.
20. Choi SY, Kahyo H. Effect of cigarette smoking and alcohol consumption in the etiology of cancer of the oral cavity. Int J Epidemiol 1991; 20:878-85.
21. Kato I, Nomura AM, Stemmermann GN, Chyou PH. Prospective study of the association of alcohol with cancer of the upper aerodigestive tract and other sites. Cancer Causes Control 1992; 3:145-51.
22. Graham S, Dayal H, Rohrer J, Swanson M, Shultz H, Shedd D, and others. Dentition, diet, tobacco, and alcohol in the epidemiology of oral cancer. J Natl Cancer Inst 1977; 59:1611-7.
23. Macfarlane GJ, Zheng TZ, Marshall JR, Boffetta P, Niu S, Brasure J and others. Alcohol, tobacco, diet and the risk of oral cancer: a pooled analysis of three case-control studies. Eur J Cancer B Oral Oncol 1995; 31B:181-7.
24. Mashberg A, Garfinkel L, Harris S. Alcohol as a primary risk factor in oral squamous carcinoma. CA Cancer J Clin 1981; 31:146- 56.
25. Brugere J, Guenel P, Leclerc A, Rodriguez J. Differential effects of tobacco and alcohol in cancer of the larynx, pharynx, and mouth. Cancer 1986; 57:391-5.
26. Wynder EL, Stellman SD. Comparative epidemiology of tobacco-related cancers. Cancer Res 1977; 37:4608-22.
27. Franco EL, Kowalski LP, Kanda JL. Risk factors for second cancers of the upper respiratory and digestive systems: a case-control study. J Clin Epidemiol 1991; 44:615-25.
28. Jovanovic A, van der Tol IG, Schulten EA, Kortense PJ, de Vries N, Snow GB, and others. Risk of multiple primary tumors following oral squamous-cell carcinoma. Int J Cancer 1994; 56:320-3.
29. Boyle P, Macfarlane GJ, Maisonneuve P, Zheng T, Scully C, Tedesco B. Epidemiology of mouth cancer in 1989; a review. J R Soc Med 1990; 83:724-30.
30. International Agency for Research in Cancer Monographs. Studies in Cancer in Humans 1995; 64:189-92.
31. Spitz MR. Epidemiology and risk factors for head and neck cancer. Sem Oncol 1994; 21:281-8.
32. Gorsky M, Silverman S Jr. Denture wearing and oral cancer. J Prosthet Dent 1984; 52:164-6.
33. Zheng TZ, Boyle P, Hu HF, Duan J, Jian PJ, Ma DQ, and others. Dentition, oral hygiene, and risk of oral cancer: a case-control study in Beijing, People’s Republic of China. Cancer Causes Control 1990; 1:235-41.
34. Morse DE, Katz RV, Pendrys DG, Holford TR, Krutchkoff DJ, Eisenberg E, and others. Mouthwash use and dentures in relation to oral epithelial dysplasia. Oral Oncol 1997; 33:338-43.
35. World Health Organization. Control of oral cancer in developing countries. Bulletin of the World Health Organization 1984; 62:817-830.
36. Ko YC, Huang YL, Lee CH, Chen MJ, Lin LM, Tsai SC. Betel quid chewing, cigarette smoking and alcohol consumption related to oral cancer in Taiwan. J Oral Pathol Med 1995; 24:450-3.
37. Gupta PC, Pindborg JJ, Mehta FS. Comparison of carcinogenicity of betel quid with and without tobacco: an epidemiological review. Ecol Dis 1982; 1:213-9.
38. Johnson NW, Warnakulasuriya KA. Epidemiology and aetiology of oral cancer in the United Kingdom. Community Dent Health 1993; 10(Suppl 1):13-29.
39. Cohen SJ, Stookey GK, Katz BP, Drook CA, Smith DM. Encouraging primary care physicians to help smokers quit: a randomized controlled trial. Ann Intern Med 1989; 110:648- 52.
40. Cohen SJ, Stookey GK, Katz BP, Drook CA, Christen AG. Helping smokers quit: a randomized controlled trial with private practice dentists. J Am Dent Assoc 1989; 118:41-5.
41. Little SJ, Stevens VJ, Severson HH, Lichtenstein E. Effective smokeless tobacco intervention for dental hygiene patients. J Dent Hyg 1992; 66:185-90.
42. Centers for Disease Control. Physician and other health-care professional counseling of smokers to quit — United States, 1991. MMWR Morb Mortal Wkly Rep 1993; 42:854-7.
43. Secker-Walker RH, Solomon LJ, Flynn BS, Dana GS. Comparisons of the smoking cessation counseling activities of six types of health professionals. Prev Med 1994; 23:800-8.
44. Martin LM, Bouquot JE, Wingo PA, Heath CW Jr. Cancer prevention in the dental practice: oral cancer screening and tobacco cessation advice. J Public Health Dent 1996; 56:336-40.
45. Wallace P, Cutler S, Haines A. Randomised controlled trial of general practitioner intervention in patients with excessive alcohol consumption. BMJ 1988; 297:663-8.
46. Kahan M, Wilson L, Becker L. Effectiveness of physician-based interventions with problem drinkers: a review. CMAJ 1995; 152:851-9.
47. A cross-national trial of brief interventions with heavy drinkers. World Health Organization Brief Intervention Study Group. Am J Public Health 1996; 86:948-55.
48. Fleming MF, Barry KL, Manwell LB, Johnson K, London R. Brief physician advice for problem alcohol drinkers. A randomized controlled trial in community-based primary care practices. JAMA 1997; 277:1039-45.
49. Mehta FS, Gupta PC, Bhonsle RB, Murti PR, Daftary DK, Pindborg JJ. Detection of oral cancer using basic health workers in an area of high oral cancer incidence in India. Cancer Detect Prev 1986; 9:219-25.
50. Ikeda N, Ishii T, Iida S, Kawai T. Epidemiological study of oral leukoplakia based on mass screening for oral mucosal diseases in a selected Japanese population. Community Dent Oral Epidemiol 1991; 19:160-3.
51. Downer MC, Evans AW, Hughes Hallett CM, Jullien JA, Speight PM, Zakrzewska JM. Evaluation of screening for oral cancer and precancer in a company headquarters. Community Dent Oral Epidemiol 1995; 23:84-8.
52. Jullien JA, Downer MC, Zakrzewska JM, Speight PM. Evaluation of a screening test for early detection of oral cancer and precancer. Community Dent Health 1995; 12:3-7.
53. Mathew B, Sankaranarayaan R, Sunilkumar KB, Kuvurila B, Pisani P, Nair MK. Reproducibility and validity of oral visual inspection by trained health workers in the detection of oral precancer and cancer. Br J Cancer 1997; 76:390-4.
54. Bouquot JE, Gorlin RJ. Leukoplakia, lichen planus, and other oral keratoses in 23,616 white Americans over the age of 35 years. Oral Surg Oral Med Oral Pathol 1986; 61:373-81.
55. Banoczy J, Rigo O. Prevalence study of oral precancerous lesions within a complex screening system in Hungary. Community Dent Oral Epidemiol 1991; 19:265-7.
56. Frenandez Garrote L, Sankaranarayanan R, Lence Anta JJ, Rodriguez Salva A, Maxwell Parkin D. An evaluation of the oral cancer control program in Cuba. Epidemiol 1995; 6:428-31.
57. Field EA, Morrison T, Darling AE, Parr TA, Zakrzewska JM. Oral mucosal screening as an integral part of routine dental care. Br Dent J 1995; 179:262-6.
58. Talamini R, Barzan L, Franceschi S, Caruso G, Gasparin A, Comoretto R. Determinants of compliance with an early detection programme for cancer of the head and neck in north-eastern Italy. Eur J Cancer B Oral Oncol 1994; 30B:415-8.
59. Rosenberg D, Cretin S. Use of meta-analysis to evaluate tolonium chloride in oral cancer screening. Oral Surg Oral Med Oral Pathol 1989; 67:621-7.
60. Epstein JB, Scully C, Spinelli JJ. Toluidine blue and Lugol’s iodine application in the assessment of oral malignant disease and lesions at risk of malignancy. J Oral Pathol Med 1992; 21:160-3.
61. Epstein JB, Oakley C, Millner A, Emerton S, van der Meij E, Le N. The utility of toluidine blue application as a diagnostic aid in patients previously treated for upper oropharyngeal carcinoma. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1997; 83:537-47.
62. Karabulut A, Reibel J, Therkildsen MH, Praetorius F, Nielsen HW, Dabelsteen E. Observer variability in the histologic assessment of oral premalignant lesions. J Oral Pathol Med 1995; 24:198-200.
63. Abbey LM, Kaugars GE, Gunsolley JC, Burns JC, Page DG, Svirsky JA, and others. Intraexaminer and interexaminer reliability in the diagnosis of oral epithelial dysplasia. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1995; 80:188-91.
64. Abbey LM, Kaugars GE, Gunsolley JC, Burns JC, Page DG, Svirsky JA, and others. The effect of clinical information on the histopathologic diagnosis of oral epithelial dysplasia. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998; 85:74-7.
65. Epstein JB, Scully C. Assessing the patient at risk for oral squamous cell carcinoma. Spec Care Dent 1997; 17:120-8.
66. Kabat GC, Chang CJ, Wynder EL. The role of tobacco, alcohol use, and body mass index in oral and pharyngeal cancer. Int J Epidemiol 1994; 23:1137-44.
67. Gupta PC, Mehta FS, Pindborg JJ, Bhonsle RB, Murti PR, Daftary DK, and others. Primary prevention trial of oral cancer in India: a 10-year follow-up study. J Oral Pathol Med 1992; 21:433-9.
68. Sussman S, Dent CW, Stacy AW, Sun P, Craig S, Simon TR, and others. Project towards no tobacco use: 1-year behaviour outcomes. Am J Public Health 1993; 83:1245-50.
69. Elder JP, Wildey M, de Moor C, Sallis JF Jr, Eckhardt L, Edwards C, and others. The long-term prevention of tobacco use among junior high school students: classroom and telephone interventions. Am J Public Health 1993; 83:1239-44.
70. Stevens MM, Freeman DH Jr, Mott LA, Youells FE, Linsey SC. Smokeless tobacco use among children: the New Hampshire study. Am J Prev Med 1993; 9:160-7.
71. U.S. Department of Health and Human Services, Public Health Service, National Institute of Health: Smoking and Tobacco Control Monograph 2. Smokeless tobacco or health: An international perspective. September 1992.
72. Axell T. Occurrence of leukoplakia and some other oral white lesions among 20,333 adult Swedish people. Community Dent Oral Epidemiol 1987; 15:46-51.
73. Hogewind WF, van der Waal I. Prevalence study of oral leukoplakia in a selected population of 1000 patients from the Netherlands. Community Dent Oral Epidemiol 1988; 16:302-5.
74. Malaovalla AM, Silverman S, Mani NJ, Bilimoria KF, Smith LW. Oral cancer in 57,518 industrial workers of Gujarat, India: A prevalence and follow-up study. Cancer 1976; 37:1882-6.
75. Banoczy J. Follow-up studies in oral leukoplakia. J Maxillofac Surg 1977; 5:69-75.
76. Gupta PC, Mehta FS, Daftary DK, Pindborg JJ, Bhonsle RB, Jalnawalla PN, and others. Incidence rates of oral cancer and natural history of oral precancerous lesions in a 10-year follow-up study of Indian villagers. Community Dent Oral Epidemiol 1980; 8:283-333.
77. Banoczy J, Csiba A. Occurrence of epithelial dysplasia in oral leukoplakia. Analysis and follow up study of 120 cases. Oral Surg Oral Med Oral Pathol 1976; 42:766-74.
78. Pindborg JJ, Daftary DK, Mehta FS. A follow-up study of sixty-one oral dysplastic precancerous lesions in Indian villagers. Oral Surg Oral Med Oral Pathol 1977; 43:383-90.
79. Silverman S Jr, Gorsky M, Lozada F. Oral leukoplakia and malignant transformation. A follow-up study of 257 patients. Cancer 1984; 53:563-8.
80. Lumerman H, Freedman P, Kerpel S. Oral epithelial dysplasia and the development of invasive squamous cell carcinoma. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1995; 79:321-9.
81. Mashberg A. Erythroplasia: the earliest sign of asymptomatic oral cancer. J Am Dent Assoc 1978; 96:615-20.
82. Mashberg A, Feldman LJ. Clinical criteria for identifying early oral and oropharyngeal carcinoma: erythroplasia revisited. Am J Surg 1988; 156:273-5.
83. Axell T, Rundquist L. Oral lichen planus — a demographic study. Community Dent Oral Epidemiol 1987; 15:52-6.
84. Fulling HJ. Cancer development in oral lichen planus. A follow-up study of 327 patients. Arch Dermatol 1973; 108:667-9.
85. Silverman S Jr, Griffith M. Studies on oral lichen planus. II. Follow-up on 200 patients, clinical characteristics, and associated malignancy. Oral Surg Oral Med Oral Pathol 1974; 37:705-10.
86. Silverman S Jr, Gorsky M, Lozada-Nur F. A prospective follow-up study of 570 patients with oral lichen planus: persistence, remission, and malignant association. Oral Surg Oral Med Oral Pathol 1985; 60:30-4.
87. Markopoulos AK, Antoniades D, Papanayotou P, Trigonidis G. Malignant potential of oral lichen planus: a follow-up study of 326 patients. Oral Oncol 1997; 33:263-9.
88. Mincer HH, Coleman SA, Hopkins KP. Observations on the clinical characteristics of oral lesions showing histologic epithelial dysplasia. Oral Surg Oral Med Oral Pathol 1972; 33:389-99.
89. Silverman S Jr, Gorsky M, Lozada F. Oral leukoplakia and malignant transformation. A follow-up study of 257 patients. Cancer 1984; 53:563-8.
90. Vedtofte P, Holmstrup P, Hjorting-Hansen E, Pindborg JJ. Surgical treatment of premalignant lesions of the oral mucosa. Int J Oral Maxillofac Surg 1987; 16:656-64.
91. Roodenburg JL, Panders AK, Vermey A. Carbon dioxide laser surgery of oral leukoplakia. Oral Surg Oral Med Oral Pathol 1991; 71:670-4.
92. Hong WK, Endicott J, Itri LM, Doos W, Batsakis JG, Bell R, and others. 13-cis-retinoic acid in the treatment of oral leukoplakia. N Engl J Med 1986; 315:1501-05.
93. Lippman SM, Batsakis JG, Toth BB, Weber RS, Lee JJ, Martin JW, and others. Comparison of low-dose isotretinoin with beta carotene to prevent oral carcinogenesis. N Engl J Med 1993; 328:15-20.
94. Toma S, Benso S, Albanese E, Palumbo R, Cantoni E, Nicolo G, and others. Treatment with oral leukoplakia with beta- carotene. Oncology 1992; 49:77-81.
95. Epstein JB, Wong FL, Millner A, Le ND. Topical bleomycin treatment of oral leukoplakia: a randomized double-blind clinical trial. Head Neck 1994; 16:539-44.
96. Decroix Y, Ghossein NA. Experience of the Curie Institute in treatment of cancer of the mobile tongue: I. Treatment policies and results. Cancer 1981; 47:496-502.
97. Callery CD, Spiro RH, Strong EW. Changing trends in the management of squamous carcinoma of the tongue. Am J Surg 1984; 148:449-54.
98. Mendenhall WM, Parsons JT, Stinger SP, Cassisi NJ, Million RR. T2 oral tongue carcinoma treated with radiotherapy: analysis of local control and complications. Radiother Oncol 1989; 16:275-81.
99. Nason RW, Sako K, Beecroft WA, Razack MS, Bakamjian VY, Shedd DP. Surgical management of squamous cell carcinoma of the floor of the mouth. Am J Surg 1989; 158:292-6.
100. Wildt J, Bjerrum P, Elbrond O. Squamous cell carcinoma of the oral cavity: a retrospective analysis of treatment and prognosis. Clin Otolaryngol 1989; 14:107-13.
101. Soderholm AL. Oral carcinoma of the mandibular region. Br J Oral Maxillofac Surg 1990; 28:383-9.
102. Franceshi D, Gupta R, Spiro RH, Shah JP. Improved survival in the treatment of squamous carcinoma of the oral tongue. Am J Surg 1993; 166:360-5.
103. Kraus DH, Vastola P, Huvos AG, Spiro RH. Surgical management of squamous cell carcinoma of the base of the tongue. Am J Surg 1993; 166:384-8.
104. Lefebvre JL, Coche-Dequeant B, Buisset E, Mirabel X, Van JT, Prevost B. Management of early oral cavity cancer. Experience of Centre Oscar Lambret. Eur J Cancer B Oral Oncol 1994; 30B:216-20.
105. Haggerty JL. Early detection and counseling of problem drinking. In: The Canadian guide to clinical practice health care. The Canadian Task Force on the Periodic Health Examination. Ottawa: Minister of Supply and Services, 1994.
106. DiGuiseppi C, Atkins D, Woolf SH (eds.). US Preventive Services Task Force. Guide to clinical preventive services, 2nd edition. Alexandria, VA: International Medical Publishing, 1996.
107. United Kingdom working group on screening for oral cancer and precancer. Conclusions and recommendations. Community Dent Health 1993; 10(Suppl 1):87-9.
108. Rodrigues VC, Moss SM, Tuomainen H. Oral cancer in the UK: to screen or not to screen. Oral Oncol 1998; 34:454-65.
109. American Cancer Society. Update January 1992: the American Cancer Society guidelines for the cancer-related checkup. CA Cancer J Clin 1992; 42:44-5.
110. Doherty SA. Basic issues in screening for oral cancer among male subpopulation. J Tenn Dent Assoc 1989; 69:26-9.
111. Meskin LH. Views: oral cancer — the forgotten disease. J Am Dent Assoc 1994; 125:1042-5.
112. O’Malley MS, Fletcher SW. US Preventive Services Task Force. Screening for breast cancer with breast self-examination. A critical review. JAMA 1987; 257:2196-203.
113. Speight PM, Elliot AE, Jullien JA, Downer MC, Zakzrewska JM. The use of artificial intelligence to identify people at risk of oral cancer and precancer. Br Dent J 1995; 179:382-7.
114. Downer MC, Jullien JA, Speight PM. An interim determination of health gain from oral cancer and precancer screening: 3. preselecting high risk individuals. Community Dent Health 1998; 15:72-6.
115. Amsel Z, Strawitz JG, Engstrom PF. The dentist as a referral source of first episode head and neck cancer patients. J Am Dent Assoc 1983; 106:195-7.
116. Paauw DS, Wenrich MD, Curtis JR, Carline JD, Ramsey PG. Ability of primary care physicians to recognize physical findings associated with HIV infection. JAMA 1995; 274:1380-2.
117. Lovas JL, Daley TD, Kaugars GE, Wright JM. Errors in the diagnosis of oral malignancies. J Can Dent Assoc 1993; 59:935-8.
118. Maguire BT, Roberts EE. Dentists’ examination of the oral mucosa to detect oral cancer. J Public Health Dent 1994; 54:115.
119. Yellowitz JA, Goodman HS, Wertheimer DA. Physicians’ and dentists’ oral cancer knowledge and practices. J Public Health Dent 1994; 54:115.